Der Prosigna-Assay, der auf den Grundlagen der Brustkrebsbiologie basiert, bietet das nötige Vertrauen, um die richtigen Entscheidungen zu treffen.
Die Kenntnis und das Vertrauen in die Bestimmung des Rezidivrisikos ist ein wichtiger Faktor bei der Entscheidung, welche Behandlung bei HR-positivem/HER2-negativem Mammakarzinom zu empfehlen ist.1

Der Prosigna Breast Cancer Assay ist für postmenopausale Frauen mit HR-positivem und HER2-negativem Mammakarzinom im Frühstadium bestimmt.
Der Prosigna Prognostic Gene Signature Assay ist ein Test der 2. Generation, der im Vergleich zu älteren Genomtests eine verbesserte Leistung zeigt.
Der Prosigna-Rezidivrisiko-Score (ROR) ergänzt herkömmliche Risikofaktoren wie die pathologische Analyse des Tumors und immunhistochemisch nachgewiesene Proteinmarker um wichtige prognostische Informationen.2
liefert genauere prognostische Informationen über das Risiko eines Fernrezidivs als die Genexpression und die immunhistochemischen Biomarker.2
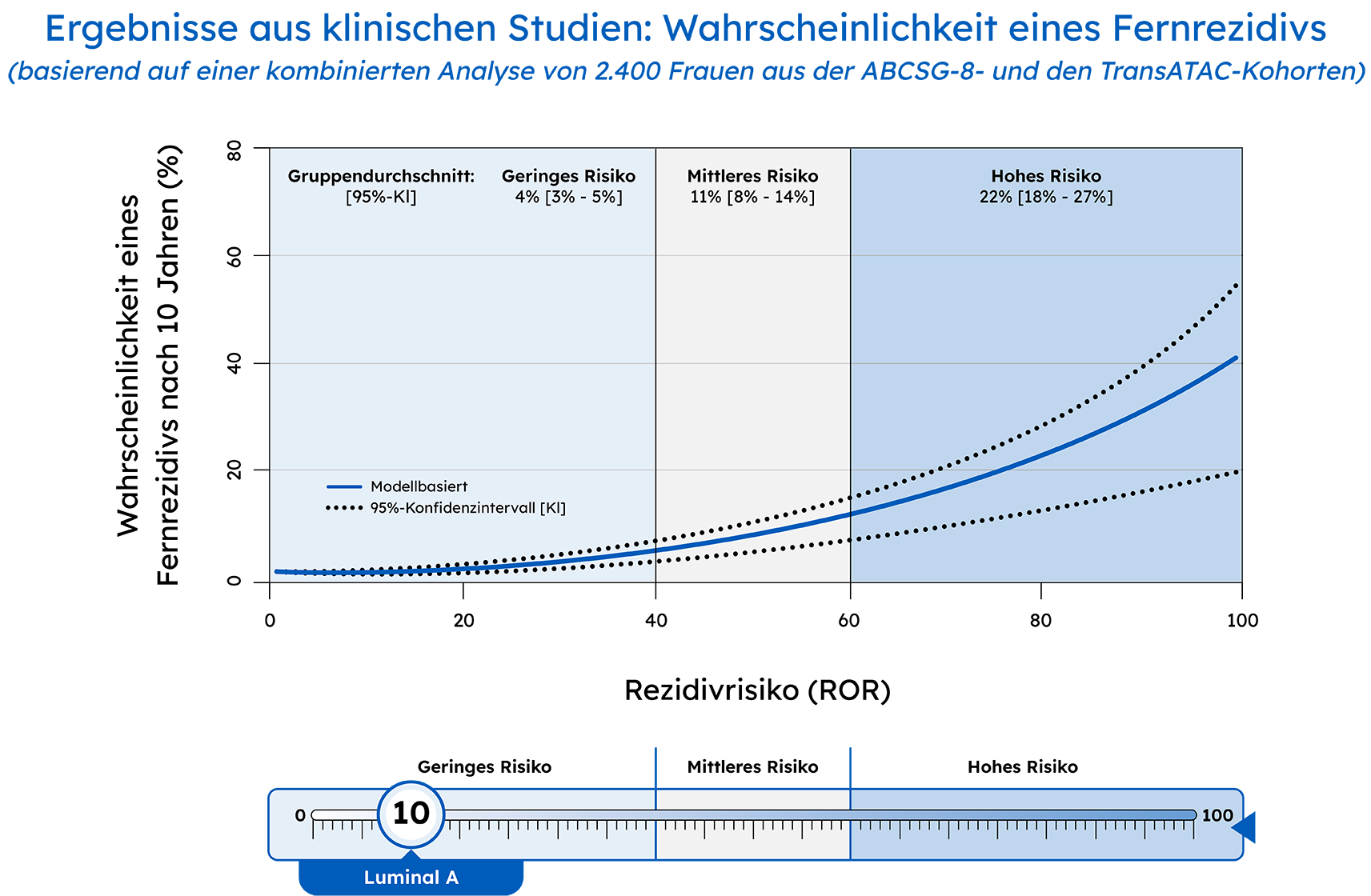
Der Prosigna-Assay klassifiziert Patientinnen genau nach niedrigem, mittlerem oder hohem Risiko eines Fernrezidivs.

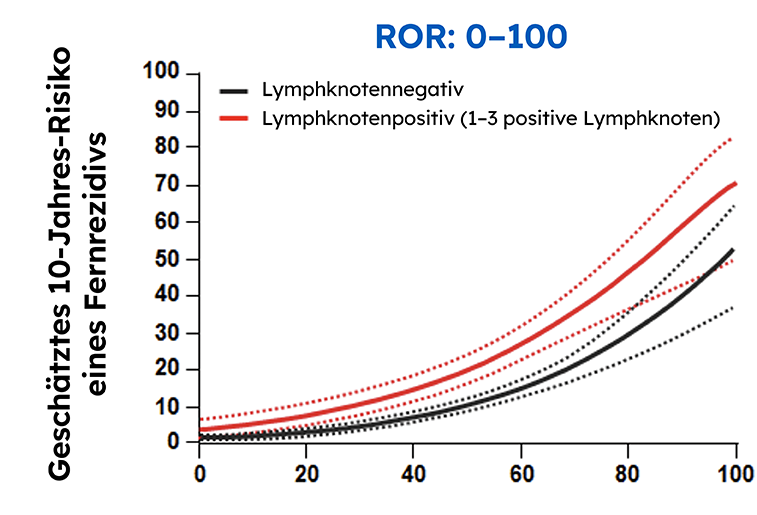
In einer Real-Word Data Situation identifizierte der Prosigna-Assay zuverlässig Patientinnen mit niedrigem Risiko, die entweder lymphknotennegativ waren oder einen bis drei positive Lymphknoten aufwiesen, was Klinikern bei der Entscheidung helfen könnte, ob eine Patientin eine adjuvante Chemotherapie sicher vermeiden kann.3 Die Danish Breast Cancer Cooperative Group (DBCG) untersuchte Fernrezidive in einer umfassenden landesweiten Kohorte, die aus 2.558 postmenopausalen Frauen mit Hormonrezeptor-positivem Brustkrebs im Frühstadium bestand, die mit einer 5-jährigen alleinigen endokrinen Therapie behandelt wurden3
Der Prosigna Rezidivrisiko-Score hat die Wahrscheinlichkeit eines 10-Jahres-Fernrezidivs in dieser Population genauer eingeschätzt als die Risikostratifizierung durch andere Gen-Panels.3.4
Eine akkurate Prognose ist die Grundlage für Empfehlungen zur Langzeitbehandlung
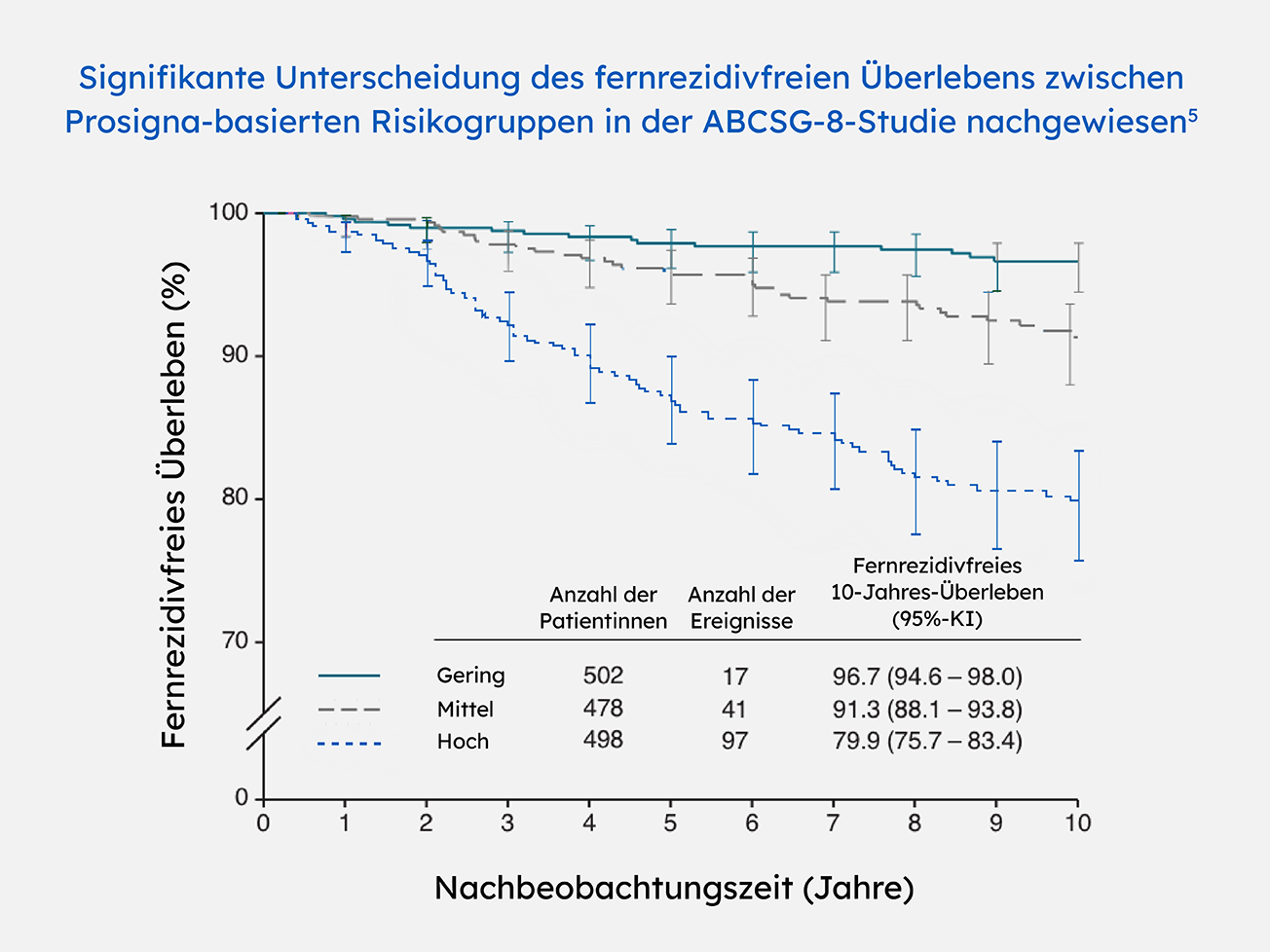
Umfassende globale Belege für die klinische Validität und den klinischen Nutzen bei mehr als 5.200 Patientinnen, die mit einer 5 Jahre dauernden Standard-Hormontherapie behandelt und über einen 10-Jahres-Zeitraum nachbeobachtet wurden (prospektiv und populationsbezogen)
Die Unterscheidung zwischen geringem und hohem Risiko ist ein Schlüsselfaktor für eine sichere Behandlungsentscheidung.
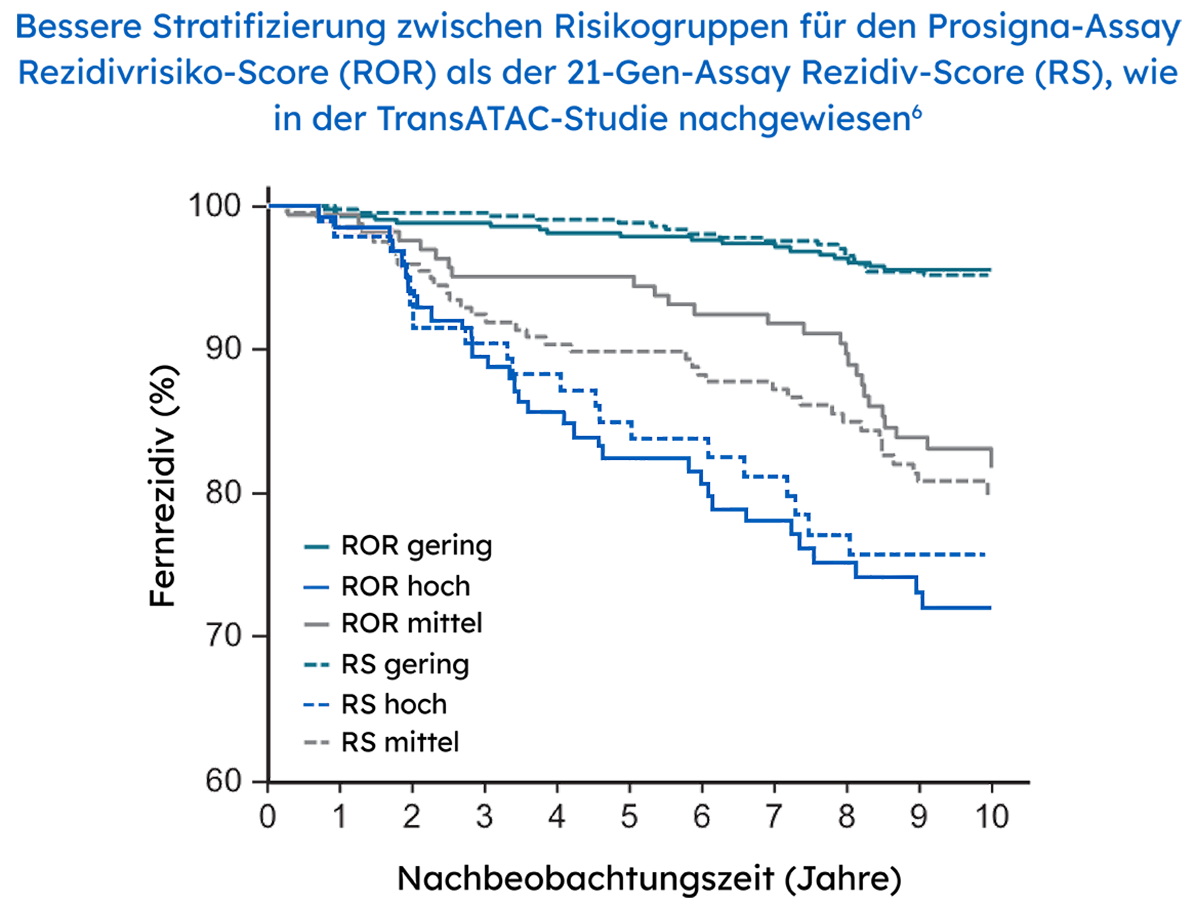
Die Ergebnisse des Rezidivrisikos von mehr als der Hälfte (59%) der Patientinnen in der Subanalyse von 663 der ursprünglich 774 Proben innerhalb der TransATAC-Studie stimmten nicht mit denen des Prosigna und Oncotype Dx überein. Die beobachteten Ergebnisse entsprechen eher der Prosigna-Risikokategorie als der Oncotype DX-Risikokategorie.6
Der Prosigna-Assay liefert genaue prognostische Informationen
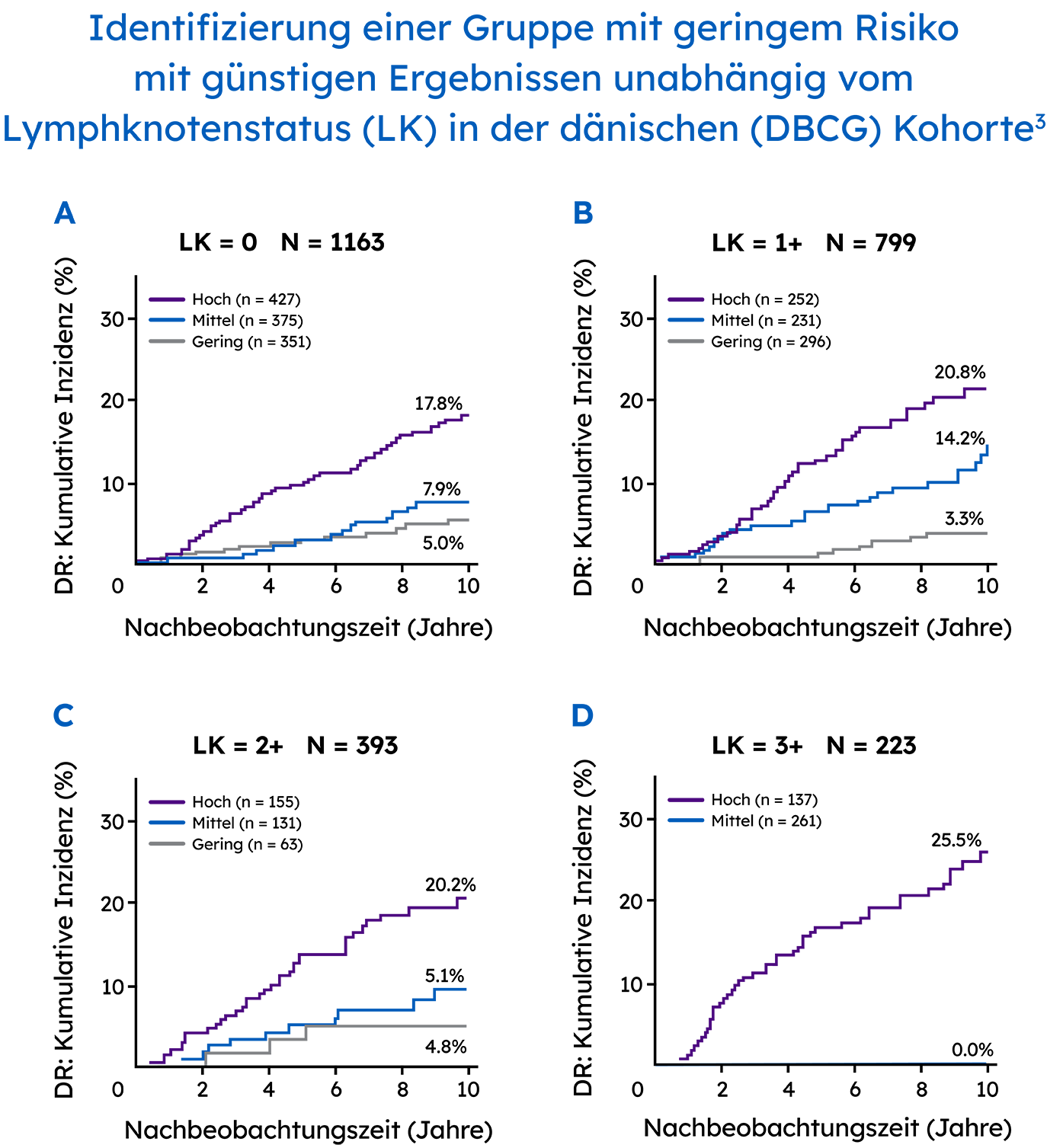 Identifizierung von Patientinnen, bei denen eine Übertherapie sicher vermieden werden kann
Identifizierung von Patientinnen, bei denen eine Übertherapie sicher vermieden werden kann


Der Prosigna Genexpressions-Assay ist der einzige prognostische Test für Brustkrebs, der auf Grundlage der vier molekularen PAM50-Subtypen entwickelt wurde.9
Die Einteilung in die intrinsischen Subtypen ermöglicht eine genauere Bewertung der Genexpressionsmuster von Tumoren.10

Zwischen den IHC-basierten Subtypen und den molekularen Prosigna-Subtypen besteht eine erhebliche Diskrepanz 10
Die Patientenergebnisse basierend auf molekularen Subtypen wurden in einem direkten Vergleich mit IHC bewertet, und der Prosigna-Assay erwies sich als genauer.6 Fehler bei der Zuordnung des Subtyps können die Behandlung von Brustkrebs und die Ergebnisse erheblich beeinträchtigen (Internationaler Expertenkonsens St. Gallen11).
Prosigna wird in Verbindung mit anderen klinisch-pathologischen Variablen als Entscheidungshilfe für eine adjuvante systemische Therapie bei Frauen mit lymphknotennegativem ESBC empfohlen.
Der Prosigna-Assay wird mit einem Evidenzgrad 1 anerkannt, der dem anderer etablierter Genexpressions-Assays gleichkommt. PAM50-basierte molekulare Subtypen werden empfohlen, um den Nutzen einer neoadjuvanten Chemotherapie vorherzusagen
Der Prosigna-Assay hat von allen Tests die größte Unterstützung für die Prognose in den Jahren 1–5 für Mammakarzinome im Frühstadium vom Typ ER-positiv, HER2-negativ, pN0 und pN-positiv erhalten.
Der Prosigna-Assay hat von allen Tests die größte Unterstützung für Spätrezidive (Jahre 5–10) erhalten.
Die PAM50-Subtypen werden von diesem Gremium als prädiktiv anerkannt.
Der Prosigna-Assay wird als Option für die Entscheidung über eine adjuvante Chemotherapie bei Patientinnen mit HR-positivem/HER2-negativem Lymphknoten(LN)-negativem und LN-positivem Brustkrebs im Frühstadium
Der Prosigna® Breast Cancer Prognostic Gene Signature Assay (Prosigna-Assay) zur Verwendung auf dem nCounter® Analysesystem besitzt eine CE-Kennzeichnung für die In-vitro-Diagnostik zur Prognose und chirurgischen Resektion. Die jeweiligen Produktangaben entnehmen Sie bitte den regionsspezifischen Packungsbeilagen.
Prosigna® verfügt gemeinsam mit dem nCounter® Analysesystem über die CE-Kennzeichnung für die In-vitro-Diagnostik bei postmenopausalen Frauen mit Hormonrezeptor-positivem (HR+), lymphknotennegativem Mammakarzinom im Stadium I oder II und bei postmenopausalen Frauen mit Hormonrezeptor-positivem (HR+), lymphknotenpositivem (1–3 positive Lymphknoten) Mammakarzinom im Stadium II und IIIA, die mit einer adjuvanten endokrinen Therapie behandelt werden sollen. Weitere Einzelheiten finden Sie in der Packungsbeilage auf prosigna.com. © 2021 Veracyte, Inc. Prosigna und das Prosigna-Logo sind Marken und/oder eingetragene Marken von Veracyte, Inc. in verschiedenen Gerichtsbarkeiten.
ASCO und ESMO sind eingetragene Warenzeichen der American Society for Clinical Oncology und der European Society for Medical Oncology. National Institute for Health and Care Excellence (NICE), St. Gallen International Consensus Panel, ASCO und ESMO unterstützen keine Produkte oder Behandlungen.

Operation: Brusterhaltende Operation (BCS) und Sentinel-Lymphknoten-Biopsie (SLNB)
Pathologie: Invasives duktales Karzinom (IDC) Grad III 15 mm
Relativ kleiner Tumor
Subtyp: Luminal A
Prosigna-Rezidivrisiko-Score (ROR): 25
Prosigna-Risikogruppe: 4%, niedriges Risiko

Operation: Brusterhaltende Operation (BCS) und Sentinel-Lymphknoten-Biopsie (SLNB)
Pathologie: Invasives duktales Karzinom (IDC) Grad III 17 mm
Relativ kleiner Tumor mit ungünstiger Biologie
Subtyp: Luminal B
Prosigna-Rezidivrisiko-Score (ROR): 70
Prosigna-Risikogruppe: 21%, hohes Risiko

Operation: Brusterhaltende Operation (BCS) und Sentinel-Lymphknoten-Biopsie (SLNB)
Pathologie: Invasives duktales Karzinom (IDC) Grad III 15 mm
Mittelgroßer Tumor
Subtyp: Luminal A
Prosigna-Rezidivrisiko-Score (ROR): 8
Prosigna-Risikogruppe: 5%, niedriges Risiko


Zur Bestellung des Prosigna Prognostic Gene Signature Assay wenden Sie sich bitte an Veracyte unter orders@veracyte.com
References: 1. Alexandre M, et al. Cancer Manag Res. 2019;11:10353–10373. 2. Sestak I, et al. JAMA Oncol. 2018;4(4):545–553. 3. Lænkholm AVet al. J Clin Oncol. 018;10;36(8):735-740. 4. Costa et al. J Clin Oncol. 2018;10;36(8):725-727. 5. Gnant M, et al. Ann Oncol. 2014;25(2):339-45.6. Dowsett M, et al. J Clin Oncol. 2013;31(22):2783-2790. 7. Prosigna [CE-IVD Package Insert] South San Francisco, CA: Veracyte, Inc; 2022-05 LB-0032-01. 8. Parker JS, et al. J Clin Oncol. 2009;27(8):1160-1167. 9. Perou M, et al. Nature 2000; 406(6796):747–752 10. Cejalvo JM et al.Cancer Treat Rev. 2018 Jun;67:63-70. 11. Goldhirsch A, at al. Annals of Oncology 2013;24: 2206–2223.