Le test Prosigna, conçu à partir des fondements de la biologie du cancer du sein, offre la confiance nécessaire pour faire les bons choix.
Connaître le risque de récidive et se fier à cette valeur sont un facteur important à prendre en considération lors de la prise de décision quant au traitement à préconiser dans le cadre du cancer du sein RH+/HER2−.1

Le test génomique Prosigna est destiné aux femmes ménopausées atteintes d’un cancer du sein de stade précoce RH+/HER2−.
Il a été démontré que les performances de la signature génomique de 2ème génération Prosigna sont meilleures que celles des tests génomiques de première génération.
Le score du risque de récidive (ROR) Prosigna apporte plus d’informations pronostiques que les facteurs de risque classiques, tels que l’analyse histopathologique de la tumeur de la patiente et des marqueurs protéiques détectés par immunohistochimie.2
Le score de récidive ROR fournit des informations pronostiques plus précises sur le risque de récidive à distance que tous les autres tests d’expression génique et les biomarqueurs immunohistochimiques.2
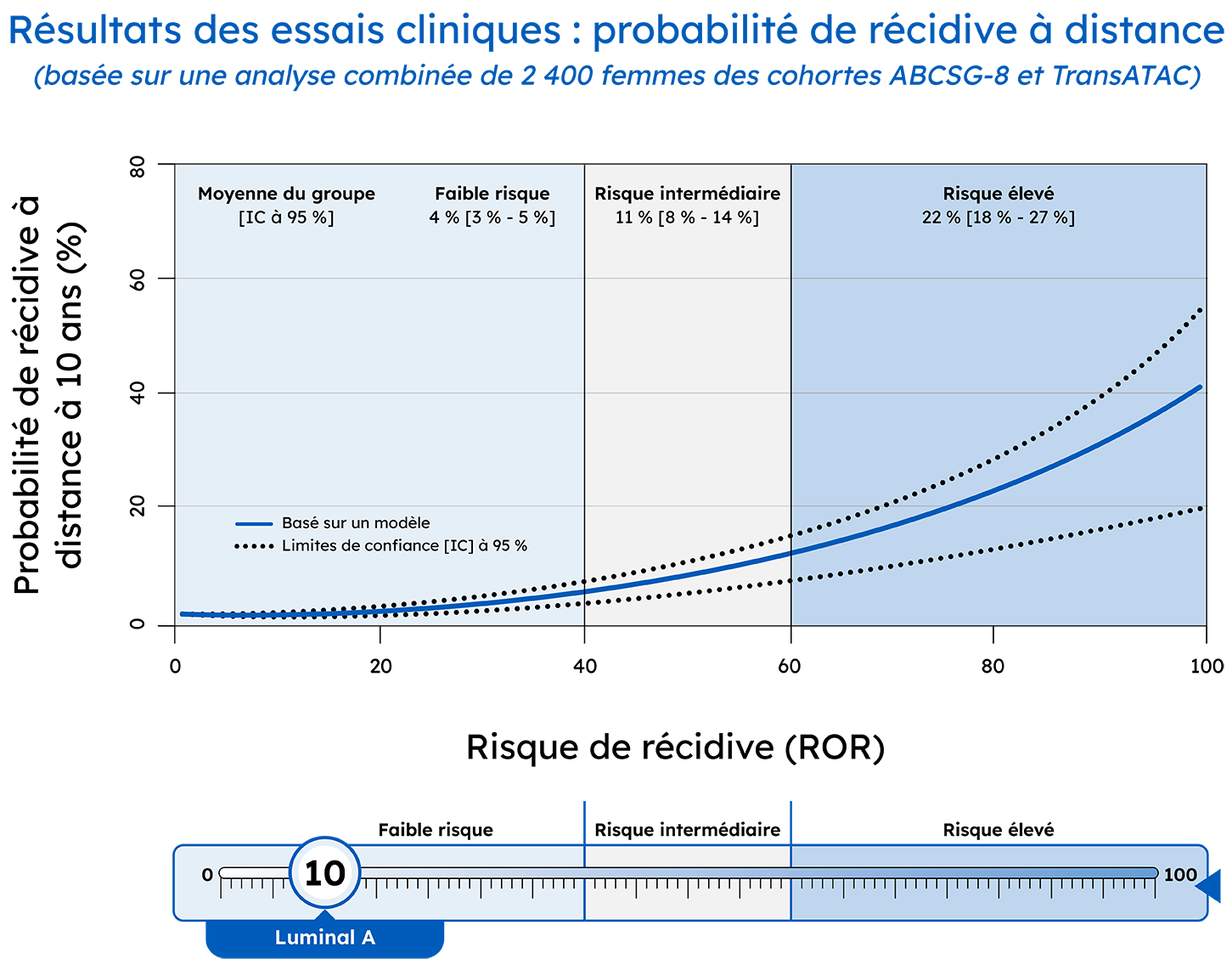
Le test Prosigna permet de classer avec précision les patientes selon qu’elles présentent un risque de récidive à distance faible, intermédiaire ou élevé.
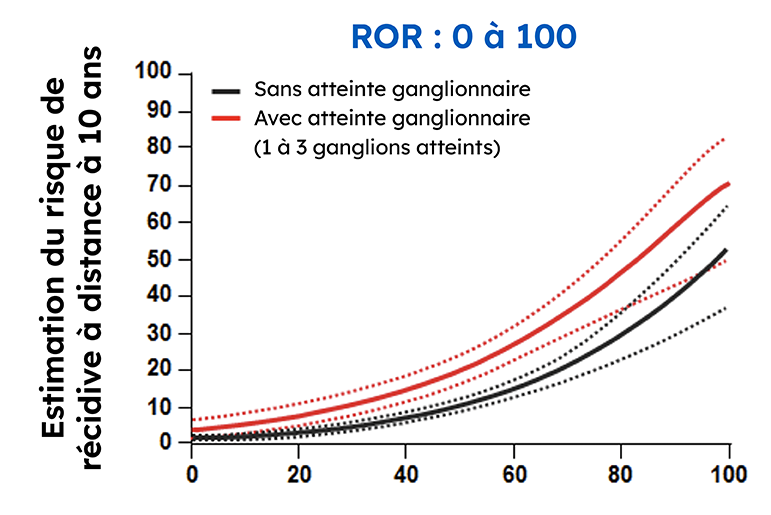
 En conditions réelles, le test Prosigna a permis d’identifier de manière fiable les patientes à faible risque qui, soit ne présentaient pas d’atteinte ganglionnaire, soit présentaient une atteinte ganglionnaire avec un à trois ganglions envahis; ceci permet d’aider les médecins à décider si une patiente peut se passer de chimiothérapie adjuvante sans perte de chance.3 Le Danish Breast Cancer Cooperative Group (DBCG) a examiné les récidives à distance dans une cohorte nationale complète composée de 2558 femmes ménopausées atteintes d’un cancer du sein hormonodépendant de stade précoce et traitées pendant 5 ans par hormonothérapie seule.3
En conditions réelles, le test Prosigna a permis d’identifier de manière fiable les patientes à faible risque qui, soit ne présentaient pas d’atteinte ganglionnaire, soit présentaient une atteinte ganglionnaire avec un à trois ganglions envahis; ceci permet d’aider les médecins à décider si une patiente peut se passer de chimiothérapie adjuvante sans perte de chance.3 Le Danish Breast Cancer Cooperative Group (DBCG) a examiné les récidives à distance dans une cohorte nationale complète composée de 2558 femmes ménopausées atteintes d’un cancer du sein hormonodépendant de stade précoce et traitées pendant 5 ans par hormonothérapie seule.3
Le score ROR Prosigna a permis d’estimer plus précisément la probabilité de récidive à distance à 10 ans dans cette population, par rapport à la stratification du risque fournie par d’autres panels de gènes.3.4
Un pronostic précis garantit un meilleur choix de traitement à long terme.
 Des données considérables de la validité clinique et de l’utilité clinique chez plus de 5 200 patientes traitées pendant 5 ans par hormonothérapie standard et un suivi sur 10 ans (prospectif et de la population).
Des données considérables de la validité clinique et de l’utilité clinique chez plus de 5 200 patientes traitées pendant 5 ans par hormonothérapie standard et un suivi sur 10 ans (prospectif et de la population).
Une prise de décision thérapeutique fiable est obtenue grace à une identification précise du risque de récidive.
 Les résultats du risque de récidive de plus de la moitié des patientes (59 %) lors de la sous-analyse de 663 échantillons sur les 774 échantillons d’origine de l’étude TransATAC étaient discordants entre le test Prosigna et le test Oncotype DX. Les résultats observés étaient plus cohérents avec la catégorie de risque du test Prosigna, mais pas avec la catégorie de risque du test Oncotype DX.6
Les résultats du risque de récidive de plus de la moitié des patientes (59 %) lors de la sous-analyse de 663 échantillons sur les 774 échantillons d’origine de l’étude TransATAC étaient discordants entre le test Prosigna et le test Oncotype DX. Les résultats observés étaient plus cohérents avec la catégorie de risque du test Prosigna, mais pas avec la catégorie de risque du test Oncotype DX.6
Le test Prosigna fournit des informations pronostiques précises.
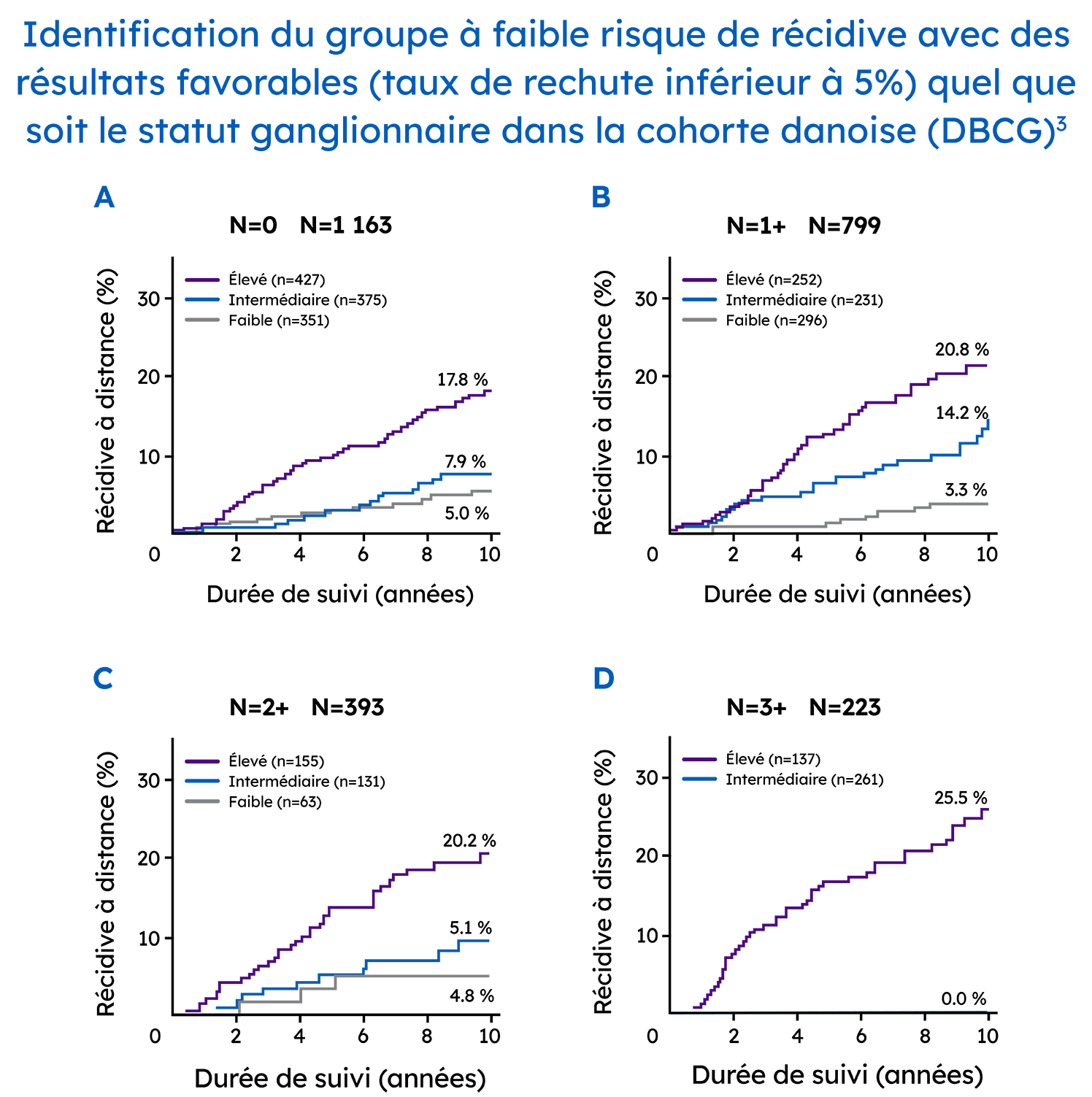
Permet d’identifier les patientes qui peuvent éviter la chimiothérapie sans perte de chance.
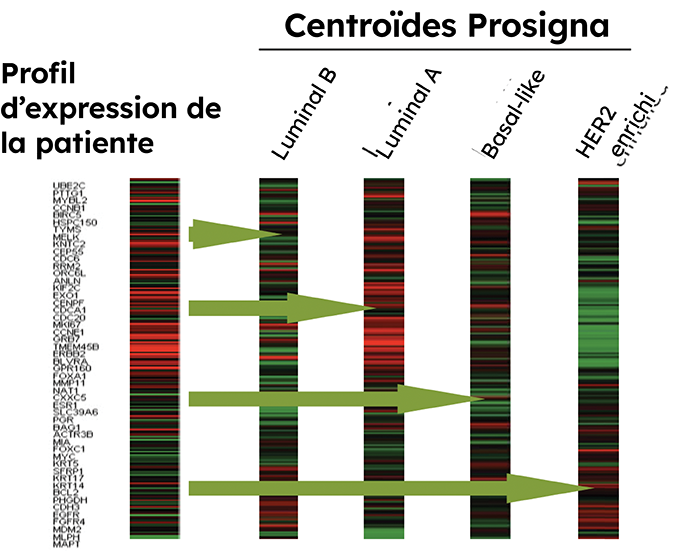
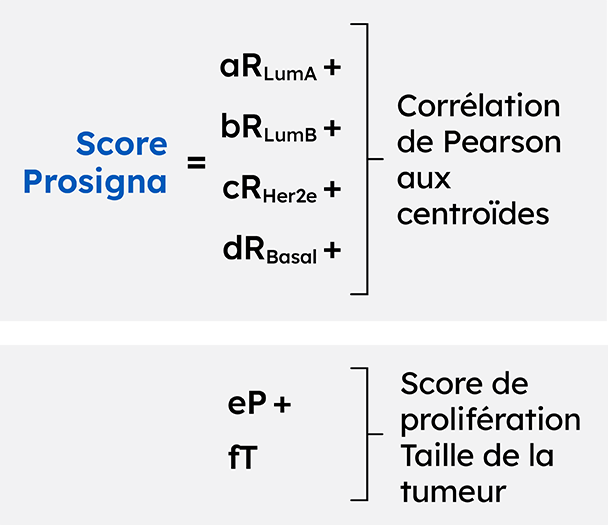
Le test génomique Prosigna est le seul test pronostique du cancer du sein développé à partir des quatre sous-types moléculaires PAM50.9
La classification en sous-types moléculaires permet une évaluation plus précise des profils d’expression des gènes tumoraux.10

Il existe une discordance importante entre les sous-types basés sur l’immunohistochimie et les sous-types moléculaires du test Prosigna.10
Les résultats des patientes basés sur les sous-types moléculaires ont été évalués lors d’une comparaison directe avec l’immunohistochimie, et il a été démontré que le test Prosigna était plus précis.6 Les erreurs d’attribution du sous-type peuvent impacter de manière significative le choix du traitement du cancer du sein ainsi que les résultats (consensus international d’experts de St. Gallen11).
Le test Prosigna est recommandé en conjonction avec d’autres critères anatomo-cliniques afin de guider les décisions concernant le traitement adjuvant systémique des femmes ayant un cancer du sein de stade précoce sans envahissement ganglionnaire.
Le test Prosigna est reconnu avec un niveau de preuve I comme étant similaire aux autres tests d’expression génique établis. L’utilisation des sous-types moléculaires basés sur le PAM50 est recommandée pour prédire le bénéfice apporté par la chimiothérapie néoadjuvante.
Le test Prosigna a reçu le soutien le plus élevé parmi tous les tests de pronostic dans les rechutes précoces (1 à 5 ans) dans le cancer du sein RE+, HER2−, pN0 et pN+.
Le test Prosigna a obtenu le niveau de soutien le plus élevé parmi tous les tests pour la récidive tardive (années 5 à 10).
Les sous-types PAM50 sont reconnus comme des facteurs prédictifs par Saint-Gallen.
Le test Prosigna est recommandé pour guider les décisions de chimiothérapie adjuvante chez les personnes atteintes d’un cancer du sein de stade précoce RH+/HER2− avec ou sans envahissement ganglionnaire (N+, N−)
Le test génomique Prosigna® pour le pronostique du cancer du sein s’effectue sur le système d’analyse nCounter® dispose du marquage CE pour une utilisation en diagnostic in vitro dans le cadre du pronostic et de l’exérèse chirurgicale. Veuillez consulter la notice Prosigna spécifique à votre pays pour tout connaître sur les indications d’utilisation.
Le test Prosigna® en conjonction avec le système d’analyse nCounter® dispose du marquage CE pour une utilisation en diagnostic in vitro chez les femmes ménopausées atteintes d’un cancer du sein de stade I ou II hormonodépendant (RH+) sans envahissement ganglionnaire et chez les femmes ménopausées atteintes d’un cancer du sein de stades II et IIIA hormonodépendant (RH+) ayant une atteinte ganglionnaire (1 à 3 ganglions atteints) devant être traitées par hormonothérapie adjuvante. Pour en savoir plus, consultez la notice sur prosigna.com. ©2021 Veracyte, Inc. Prosigna et le logo Prosigna sont des marques commerciales et/ou des marques déposées de Veracyte, Inc. dans divers pays.
ASCO et ESMO sont des marques déposées de American Society of Clinical Oncology et de European Society for Medical Oncology. Le National Institute for Health and Care Excellence (NICE), le St Gallen International Consensus Panel, l’ASCO et l’ESMO ne cautionnent aucun produit ou traitement.

Chirurgie: Chirurgie mammaire conservatrice et biopsie du ganglion sentinelle
Anatomopathologie: Carcinome canalaire infiltrant (CCI) de grade III de 15 mm
Tumeur relativement petite
Sous type: Luminal A
Score du risque de récidive (ROR) Prosigna: 25
Probabilité de rechute à 10 ans: 4%, risque faible

Chirurgie: Chirurgie mammaire conservatrice et biopsie du ganglion sentinelle
Anatomopathologie: Carcinome canalaire infiltrant (CCI) de grade III de 17 mm
Tumeur relativement petite à biologie défavorable
Sous type: Luminal B
Score du risque de récidive (ROR) Prosigna: 70
Probabilité de rechute à 10 ans: 21%, risque élevé

Chirurgie: Chirurgie mammaire conservatrice et biopsie du ganglion sentinelle
Anatomopathologie: Carcinome canalaire infiltrant (CCI) de grade III de 15 mm
Tumeur de taille intermédiaire
Sous type: Luminal A
Score du risque de récidive (ROR) Prosigna: 8
Probabilité de rechute à 10 ans: 5%, faible risque


Pour commander le test génomique Prosigna, veuillez contacter Veracyte à l’adresse orders@veracyte.com.
Références bibliographiques : 1. Alexandre M, et al. Cancer Manag Res. 2019;11:10353–10373. 2. Sestak I, et al. JAMA Oncol. 2018;4(4):545–553. 3. Lænkholm AVet al. J Clin Oncol. 018;10;36(8):735-740. 4. Costa et al. J Clin Oncol. 2018;10;36(8):725-727. 5. Gnant M, et al. Ann Oncol. 2014;25(2):339-45.6. Dowsett M, et al. J Clin Oncol. 2013;31(22):2783-2790. 7. Prosigna [CE-IVD Package Insert] South San Francisco, CA: Veracyte, Inc; 2022-05 LB-0032-01. 8. Parker JS, et al. J Clin Oncol. 2009;27(8):1160-1167. 9. Perou M, et al. Nature 2000; 406(6796):747–752 10. Cejalvo JM et al.Cancer Treat Rev. 2018 Jun;67:63-70. 11. Goldhirsch A, at al. Annals of Oncology 2013;24: 2206–2223.